In prima parte a acestui articol, am revizuit cadrul contractual și de reglementare aplicat de guvernul SUA pentru dezvoltarea inițială, fabricarea și achiziția injecțiilor de ARNm Covid, folosind acordurile BioNTech/Pfizer pentru a ilustra procesul.
Am arătat că autorizația de utilizare de urgență (EUA) a fost acordată acestor produse pe baza unor studii clinice și procese de fabricație efectuate cu
- fără standarde legale obligatorii,
- nicio supraveghere sau reglementare a siguranței interzisă legal și
- nicio despăgubire legală din partea producătorului pentru eventualele daune.
În acest articol următor, voi oferi o analiză detaliată a documentației de bază.
Altă autoritate/acord de tranzacție (OTA): O cale de achiziție militară
acord între guvernul SUA, reprezentat de Departamentul Apărării (DoD), și Pfizer, reprezentând parteneriatul BioNTech/Pfizer, în iulie 2020, pentru achiziționarea unui „vaccin pentru prevenirea COVID-19” nu a fost un contract de achiziție obișnuit.
A fost un acord sub o altă autoritate de tranzacții (OTA) – o cale de achiziție care, potrivit Ghidurile Departamentului de Apărare, a fost folosit din 1958 pentru a „permite unei agenții federale să intre în tranzacții, altele decât contracte, granturi sau acorduri de cooperare. "
[FAPA ADAUGATA IN GRADATE]
O revizuire amănunțită a utilizării OTA de către DoD, inclusiv istoricul său statutar, poate fi găsită în 22 februarie 2019 Raportul Serviciului de Cercetare a Congresului. Acest raport, împreună cu orice altă discuție despre OTA, specifică că este o cale alternativă de achiziție în scopuri militare și de apărare. Nu este destinat și nici nu a fost folosit vreodată înainte de Covid, pentru nimic destinat în principal utilizării civile.
Dacă căutați Legile OTA în Codul SUA, aceasta este calea pe care o vei merge:
Forțele armate -> Drept militar general -> Achiziție -> Cercetare și inginerie -> Acorduri -> Autoritatea DoD pentru realizarea anumitor proiecte prototip
Această cale legală arată foarte clar că legile OTA sunt destinate achiziției de prototipuri de cercetare și inginerie pentru forțele armate.
Departamentul Apărării are autoritate pentru trei tipuri diferite de OT: (1) OT de cercetare, (2) OT-uri prototip și (3) OT de producție.
Aceste trei tipuri de OT reprezintă trei etape de cercetare inițială, dezvoltarea unui prototip și eventuala producție.
În aceste trei tipuri, există categorii specifice de proiecte la care se poate aplica OTA:
- Inițial, conform Prezentare generală OTA furnizată de DoD, Cealaltă Autoritate de Tranzacție a fost „limitată să se aplice armelor sau sistemelor de arme propuse pentru a fi achiziționate sau dezvoltate de către DoD”.
- Ulterior, OTA a fost extinsă pentru a include „orice proiect prototip direct legat de îmbunătățirea eficienței misiunii personalului militar și a platformelor de sprijin, sistemelor, componentelor sau materialelor propuse pentru a fi achiziționate sau dezvoltate de către DoD sau cu îmbunătățirea platformelor, sistemelor, componentelor. , sau materiale utilizate de Forțele Armate.”
Până acum, nimic din toate acestea nu sună ca o cale de achiziție pentru milioane de produse medicale noi destinate în principal utilizării civile.
Există vreo excepție pentru utilizarea civilă a OTA care s-ar putea aplica vaccinurilor ARNm Covid?
FY2004 Actul de autorizare a apărării naționale (PL 108-136) conținea o secțiune care dădea „Altă Autoritate de Tranzacție” „șefului unei agenții executive care se angajează în cercetare fundamentală, cercetare aplicată, cercetare avansată și proiecte de dezvoltare” care „au potențialul de a facilita apărarea împotriva terorismului sau recuperarea din cauza terorismului sau nuclear, biologic, atac chimic sau radiologic.”
Această prevedere a fost prelungită până în 2018, dar nu pare să fi fost prelungită dincolo de acel an. De asemenea, rețineți că, chiar și în acest caz excepțional de utilizare non-DoD a OTA, situația trebuie să implice terorism sau un atac cu arme de distrugere în masă (CBRN).
Ce alte legi OTA s-ar putea aplica?
Raportul CRS din 2019 citat mai sus oferă acest grafic, care arată că câteva agenții non-DoD au unele OTA sau autorități conexe:
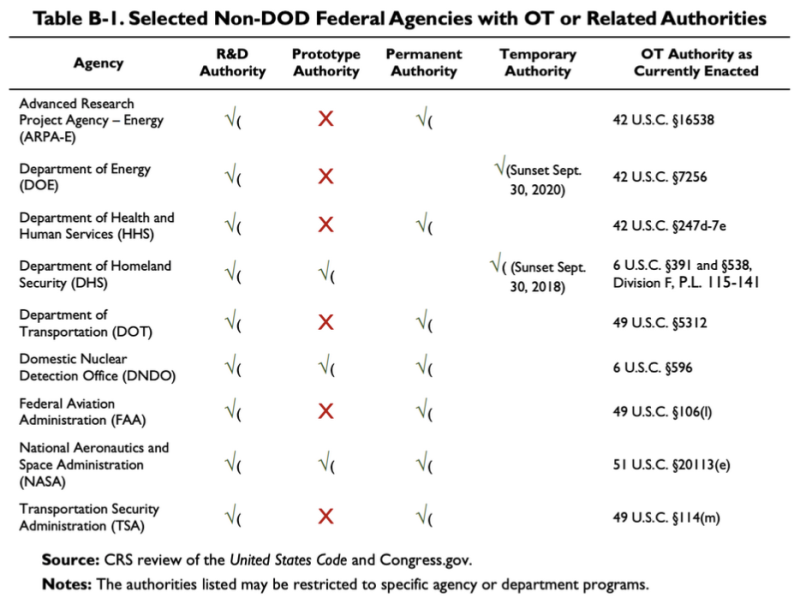
Conform acestui tabel, Departamentul de Sănătate și Servicii Umane (HHS) are unele autorități de cercetare și dezvoltare (R&D) Alte Autorități de Tranzacție. Legea referitoare la Autoritatea OT a HHS este 42 U.S.C. §247d-7e.
Unde este adăpostită această lege și ce spune ea?
Sănătatea și bunăstarea publică -> Serviciul de sănătate publică -> Puteri și obligații generale -> Cooperare federală-stat -> Autoritatea de cercetare și dezvoltare avansată în domeniul biomedical (BARDA) -> Autorități de tranzacționare
Deci, există un loc în lege legat de sănătatea și bunăstarea civilă în care OTA ar putea fi aplicabilă, deși este valabil numai pentru cercetare și dezvoltare, nu pentru prototipuri sau producție.
Legea prevede că secretarul BARDA are Autoritate OT
cu privire la un produs care este sau poate deveni a contramăsuri calificate sau un produs calificat pentru pandemie sau epidemie, activități care predominant—
(i) sunt efectuate în urma cercetării de bază și a dezvoltării preclinice a produsului; și
(ii) sunt legate de fabricarea produsului la scară comercială și într-o formă care îndeplinește cerințele de reglementare în temeiul Federal Actul privind alimentele, medicamentele și produsele cosmetice [21 USC 301 et urm.] sau sub secțiunea 262 din prezentul titlu.
[FAPA ADAUGATA IN GRADATE]
„Cerințele de reglementare” enumerate în lege înseamnă că ar fi imposibil pentru BARDA/HHS să încheie acorduri – chiar și doar cercetare și dezvoltare – pentru orice produse medicale (cum ar fi vaccinurile ARNm) care nu au fost supuse unor teste riguroase de siguranță și supraveghere strictă a producției.
„Parteneriat” HHS cu legile de protecție civilă eludate ale DoD
Pentru a rezuma situația dificilă a altor autorități/acorduri de tranzacție cu privire la autoritățile civile, în general, și vaccinurile ARNm Covid, în special:
- OTA a fost scrisă și codificată ca o modalitate prin care armata să achiziționeze arme și alte sisteme și echipamente necesare fără multă birocrație birocratică. Acesta acoperă cercetarea și dezvoltarea, prototipurile și producția ulterioară.
- Singura OTA pentru o agenție de sănătate publică este pentru HHS și acoperă doar cercetare și dezvoltare, nu prototipuri sau producție.
- Chiar și OTA de cercetare și dezvoltare acordată HHS încă impune ca produsele să fie fabricate „într-o formă care să îndeplinească cerințele de reglementare” pentru siguranța medicamentelor și a vaccinurilor.
Cu alte cuvinte: HHS nu ar fi putut folosi OTA foarte limitată pentru a semna contracte pentru sute de milioane de produse medicale noi.
Deci, ce a făcut HHS?
După cum a menționat Biroul de Responsabilitate Guvernamentală (GAO) în documentul său Raportul iulie 2021 privind „Contractarea Covid-19:” HHS a „partenerat” cu DoD pentru a „să profite de autoritățile OTA ale DoD... de care HHS îi lipsea”. (pag. 24)
Ce sunt autoritățile OT ale DoD pentru produse medicale?
După cum sa discutat, OTA are scopul de a ajuta armata să obțină echipamente și tehnologie fără multe bătăi de cap birocratice. Niciuna dintre legile originale referitoare la OTA nu a menționat altceva decât „platforme, sisteme, componente sau materiale” menite să „îmbunătățească eficiența misiunii personalului militar”.
Dar cu cinci ani înainte de Covid, a fost introdusă o utilizare excepțională a OTA:
În 2015, DoD a anunțat înființarea Consorțiului de contramăsuri medicale CBRN, al cărui scop a fost să folosească calea de achiziție OTA pentru a „colabora cu DoD pentru a dezvolta contramăsuri medicale chimice, biologice, radiologice și nucleare licențiate FDA”. [FDA = Food & Drug Administration]
După cum s-a descris în anunțul din 2015, acesta a inclus „tehnologii prototip pentru contramăsuri medicale terapeutice care vizează ținte de toxine virale, bacteriene și biologice de interes pentru DoD”. Lista agenților a inclus cei mai buni agenți patogeni de război biologic, cum ar fi antraxul, ebola și marburg.
Anunțul a continuat precizând că „tehnologiile de activare pot include modele animale de boli virale, bacteriene sau biologice cu toxine și patogeneză (cai multiple de expunere), teste, tehnologii de diagnosticare sau alte tehnologii de platformă care pot fi aplicate la dezvoltarea de MCM aprobate sau licențiate. [contramăsuri medicale].”
Deși acest lucru încă nu seamănă cu producția a 100 de milioane de vaccinuri noi pentru uz civil, oferă mai multă libertate pentru OTA decât foarte limitată Autoritate pentru alte tranzacții acordată HHS.
În timp ce HHS OTA necesită aderarea la reglementări extinse de dezvoltare și producție, calea OTA pentru ca DoD să dezvolte contramăsuri medicale necesită doar „licență FDA”.
Astfel, folosind DoD Other Transaction Authorities, teoretic ar fi posibil să ocoliți orice reglementări de siguranță – în funcție de cerințele pentru licențierea FDA a unui produs generat de OTA. După cum vom vedea, în cazul vaccinurilor cu ARNm Covid, s-a acordat autorizația de utilizare de urgență, nefiind deloc o supraveghere legală a siguranței.
Autorizație de utilizare de urgență (EUA)
Iată cum Administrația pentru Alimente și Medicamente (FDA) își descrie puterile EUA:
Secțiunea 564 din Legea FD&C (21 USC 360bbb – 3) permite FDA să consolideze protecția sănătății publice împotriva agenților biologici, chimici, nucleari și radiologici.
Cu această autoritate EUA, FDA poate ajuta să se asigure că pot fi utilizate contramăsuri medicale în situații de urgență pentru a diagnostica, trata sau preveni boli sau afecțiuni grave sau care pun viața în pericol cauzate de agenți biologici, chimici, nucleari sau radiologici atunci când nu există adecvați, aprobați. , și alternativele disponibile (printre alte criterii).
Este extrem de important de înțeles că aceste competențe EUA au fost acordate în 2004 în circumstanțe foarte specifice legate de pregătirea pentru atacuri cu arme de distrugere în masă, altfel cunoscute sub denumirea de agenți CBRN (chimici, biologici, radiologici, nucleari).
Așa cum am explicat în Bill of Health al Legii Harvard,
În cele din urmă, războiul împotriva terorii a fost cel care va da naștere autorizației de utilizare în caz de urgență. După evenimentele din 11 septembrie 2001 și atacurile ulterioare prin poștă cu antrax, Congresul a adoptat Proiectul Bioshield Act din 2004. Actul a cerut miliarde de dolari în credite pentru achiziționarea de vaccinuri în pregătirea unui atac bioteror și pentru stocarea de contramăsuri de urgență. Pentru a putea acționa rapid într-o situație de urgență, Congresul a permis FDA să autorizeze produse neaprobate oficial pentru utilizare de urgență împotriva unei amenințări la adresa sănătății și siguranței publice (sub rezerva unei declarații de urgență de către HHS). The record indică faptul că Congresul sa concentrat pe amenințarea bioteroarei, nu pe pregătirea pentru o pandemie naturală.
formularea legii EUA subliniază faptul că a fost destinat utilizării în situații care implică arme de distrugere în masă. Iată cele 4 situații în care pot fi emise EUA:
- o determinare a Secretarului pentru Securitate Internă că există o urgență internă sau un potențial semnificativ pentru o urgență internă, care implică un risc crescut de atac cu un agent sau agenți biologici, chimici, radiologici sau nucleari;
- o determinare a Secretarului Apărării că există o urgență militară sau un potențial semnificativ pentru o urgență militară, care implică un risc crescut pentru United Statele forțele militare, inclusiv personalul care operează sub autoritatea titlului 10 sau a titlului 50, de atac cu—
- un agent sau agenți biologici, chimici, radiologici sau nucleari; sau
- un agent sau agenți care pot cauza sau sunt asociate în alt mod cu un risc iminent care pune viața în pericol și specific pentru United Statele forțele militare;
- o determinare a Secretar că există o urgență de sănătate publică sau un potențial semnificativ pentru o urgență de sănătate publică, care afectează sau are un potențial semnificativ de a afecta securitatea națională sau sănătatea și securitatea United Statele cetățeni care locuiesc în străinătate și care implică un agent sau agenți biologici, chimici, radiologici sau nucleari sau o boală sau afecțiune care poate fi atribuită unui astfel de agent sau agenți; sau
- identificarea unei amenințări materiale în conformitate cu secțiunea 319F–2 din Legea Serviciului de Sănătate Publică [42 USC 247d–6b] suficient pentru a afecta securitatea națională sau sănătatea și securitatea United Statele cetăţenii care locuiesc în străinătate.
Nicăieri în aceste patru situații nu există nicio mențiune despre o epidemie, pandemie sau orice alt tip de situație de sănătate publică care nu este cauzată de „agenți biologici, chimici, radiologici sau nucleari”.
Poate SARS-CoV-2 să se califice ca un astfel de agent?
Dacă cauți definiția „agenţi biologici” în Codul juridic al SUA, veți urma următoarea cale:
Infracțiuni și procedură penală -> Infracțiuni -> Arme biologice -> Definiții
Deci, în contextul legislației Statelor Unite, termenul „agenți biologici” înseamnă arme biologice, iar utilizarea unor astfel de agenți/arme este considerată o infracțiune.
Wikipedia oferă acest lucru definiție:
Un agent biologic (numit și agent bio, agent de amenințare biologică, agent de război biologic, armă biologică sau armă biologică) este un bacterie, virus, protozoar, parazit, ciuperca, sau toxină care poate fi folosită intenționat ca armă în bioterorism or război biologic (BW).
Pe ce temei juridic a fost emis EUA pentru vaccinurile ARNm Covid?
S-ar părea, pe baza legilor referitoare la EUA, că niciuna dintre cele patru situații posibile descrise în lege nu ar putea fi aplicată unui produs destinat prevenirii sau tratarii unei boli cauzate de un agent patogen natural.
Cu toate acestea, această lege a fost folosită pentru a autoriza vaccinurile ARNm Covid.
Având în vedere cele patru opțiuni enumerate în legea EUA, cea care a fost folosită pentru „contramăsurile” Covid a fost
C) o determinare de către Secretar că există o urgență de sănătate publică sau un potențial semnificativ pentru o urgență de sănătate publică, care afectează sau are un potențial semnificativ de a afecta securitatea națională sau sănătatea și securitatea United Statele cetățeni care locuiesc în străinătate și care implică un agent sau agenți biologici, chimici, radiologici sau nucleari sau o boală sau afecțiune care poate fi atribuită unui astfel de agent sau agenți.
Cand aplicat în mod specific la Covid, așa a fost formulat:
Secretarul Departamentului de Sănătate și Servicii Umane (HHS) a stabilit că există o urgență de sănătate publică care are un potențial semnificativ de a afecta securitatea națională sau sănătatea și securitatea cetățenilor Statelor Unite care trăiesc în străinătate și care implică virusul care provoacă Coronavirus Boala 2019 (COVID-19)...
Nu există nicio îndoială aici că „virusul care provoacă COVID-19” este considerat a fi echivalentul „un agent sau agenți biologici, chimici, radiologici sau nucleari”.
De asemenea, este important de menționat că „determinarea unei urgențe de sănătate publică” EUA este complet separată și nu depinde în niciun fel de orice alte declarații de urgență de sănătate publică, cum ar fi cele făcute de OMS, guvernul SUA. , și Președintele la începutul pandemiei de Covid-19.
Deci, chiar și atunci când OMS, guvernul SUA și președintele declară că pandemia s-a încheiat, mai poate exista o autorizație de utilizare de urgență dacă secretarul HHS continuă să susțină că situația descrisă în secțiunea C) există.
Privind la toate EUA pentru sute de produse medicale legate de Covid, este foarte greu de văzut cum secretarul HHS ar putea justifica afirmația că „există o urgență de sănătate publică care are un potențial semnificativ de a afecta securitatea națională sau sănătatea și securitatea cetățenilor americani care trăiesc în străinătate” în majoritatea, dacă nu în toate, din aceste cazuri.
„Criterii statutare” suplimentare pentru ca FDA să acorde autorizație de utilizare în caz de urgență
Odată ce secretarul HHS declară că există o urgență de sănătate publică care justifică EUA, pe baza uneia dintre cele patru situații enumerate în lege, mai sunt patru „criterii statutare” care trebuie îndeplinite pentru ca FDA să emită EUA. . Iată cum explică FDA aceste cerințe:
- Boală sau afecțiune gravă sau care pune viața în pericol
Pentru ca FDA să emită un EUA, agentul (agentii) CBRN la care se face referire în declarația EUA a secretarului HHS trebuie să fie capabil să provoace o boală sau o afecțiune gravă sau care pune viața în pericol.
NOTĂ: Acest criteriu repetă specificația unui agent CBRN, care este definit legal ca o armă folosită la comiterea unei infracțiuni.
- Dovezi de eficacitate
Produsele medicale care pot fi luate în considerare pentru un EUA sunt cele care „pot fi eficiente” pentru a preveni, diagnostica sau trata boli sau afecțiuni grave sau care pun viața în pericol, care pot fi cauzate de un(i) agent(i) CBRN identificat(i) în declarația secretarului HHS de urgență sau amenințare de urgență conform secțiunii 564(b).
Standardul „poate fi eficient” pentru EUA oferă un nivel mai scăzut de dovezi decât standardul de „eficacitate” pe care FDA îl utilizează pentru aprobările produselor. FDA intenționează să evalueze potențiala eficacitate a unui posibil produs EUA de la caz la caz, folosind o analiză risc-beneficiu, așa cum este explicat mai jos.
[FAPA ADAUGATA IN GRADATE]
ÎNTREBARE LEGALĂ: Cum poate cineva să pretindă în mod legal că un produs autorizat conform EUA este „sigur și eficient” dacă standardul legal pentru EUA este „poate fi eficient” și FDA declară că acesta este un „nivel mai scăzut de dovezi” decât standardul utilizat pentru aprobări regulate de produse?
- Analiza risc-beneficiu
Un produs poate fi luat în considerare pentru un EUA dacă Comisarul stabilește că beneficiile cunoscute și potențiale ale produsului, atunci când este utilizat pentru a diagnostica, preveni sau trata boala sau starea identificată, depășesc riscurile cunoscute și potențiale ale produsului.
Pentru a determina dacă beneficiile cunoscute și potențiale ale produsului depășesc riscurile cunoscute și potențiale, FDA intenționează să se uite la totalitatea dovezilor științifice pentru a face o determinare globală risc-beneficiu. Asemenea dovezi, care ar putea apărea dintr-o varietate de surse, poate include (dar nu se limitează la): rezultate ale studiilor clinice interne și străine, date de eficacitate in vivo de la modele animale și date in vitro; disponibile pentru luarea în considerare a FDA. FDA va evalua, de asemenea, calitatea și cantitatea dovezi disponibile, având în vedere starea actuală a cunoștințelor științifice.
[FAPA ADAUGATA IN GRADATE]
NOTĂ LEGALĂ: Nu există un standard legal și nu există definiții legale pentru ceea ce înseamnă ca „beneficii cunoscute și potențiale” să depășească „riscurile cunoscute și potențiale”. De asemenea, nu există o definiție juridică calitativă sau cantitativă a ceea ce constituie „dovezi disponibile” acceptabile pe care „s-ar putea baza” analiza riscuri-beneficii. Ar putea exista zero dovezi reale, dar convingerea că un produs are multe beneficii potențiale și nu prea multe riscuri potențiale și care ar satisface această „cerință legală”.
- Fără alternative
Pentru ca FDA să emită un EUA, nu trebuie să existe o alternativă adecvată, aprobată și disponibilă la produsul candidat pentru diagnosticarea, prevenirea sau tratarea bolii sau afecțiunii. Un produs alternativ potențial poate fi considerat „indisponibil” dacă nu există rezerve suficiente de alternativă aprobată pentru a satisface pe deplin nevoia de urgență.
ÎNTREBARE LEGALĂ: În afară de denigrarea/interzicerea flagrantă și potențial criminală a tratamentelor alternative pentru Covid-19, cum ar fi ivermectina și hidroxiclorochina, în ce moment a existat o alternativă aprobată pentru „prevenirea Covid-19” (singurul lucru pentru care au fost achiziționate vaccinurile cu ARNm) ) – Paxlovid, de exemplu – ceea ce ar face ca o EUA pentru vaccinurile ARNm să nu mai fie legală?
Iată cum au fost îndeplinite toate aceste „criterii statutare” în realitate Autorizație de utilizare de urgență pentru vaccinurile ARNm BioNTEch/Pfizer Covid:
Am ajuns la concluzia că utilizarea de urgență a vaccinului Pfizer-BioNTech COVID-19 pentru prevenirea COVID-19 atunci când este administrat conform sferei de aplicare a autorizației (secțiunea II) îndeplinește criteriile pentru eliberarea unei autorizații conform secțiunii 564(c) din Actul, deoarece:
- SARS-CoV-2 poate provoca o boală sau afecțiune gravă sau care pune viața în pericol, inclusiv afecțiuni respiratorii severe, oamenilor infectați cu acest virus;
- Pe baza totalității dovezilor științifice disponibile FDA, este rezonabil să credem că vaccinul Pfizer-BioNTech COVID-19 poate fi eficient în prevenirea COVID-19și că, atunci când este utilizat în condițiile descrise în această autorizație, beneficiile cunoscute și potențiale ale vaccinului Pfizer-BioNTech COVID-19 atunci când este utilizat pentru prevenirea COVID-19 depășesc riscurile cunoscute și potențiale; și
- Nu există o alternativă adecvată, aprobată și disponibilă la utilizarea de urgență a vaccinului Pfizer-BioNTech COVID-19 pentru a preveni COVID-19.
[FAPA ADAUGATA IN GRADATE]
NOTĂ: Singurul context în care FDA a cântărit beneficiile și riscurile potențiale ale vaccinului și în care FDA a stabilit că „poate fi eficient” a fost în prevenirea Covid-19.
Nu există nicio luare în considerare, nicio dovadă a beneficiului real sau potențial și nicio determinare că există vreo eficacitate potențială ca vaccinul să facă altceva, inclusiv: scăderea riscului de boală severă, scăderea riscului de spitalizare, scăderea riscului de deces , reducând riscul apariției oricăror condiții legate efectiv sau potențial de Covid-19.
Prin urmare, s-ar putea pune la îndoială legalitatea oricăror afirmații conform cărora vaccinul este „sigur și eficient” în contextul altor lucruri decât „atunci când este folosit pentru a preveni COVID-19” – ceea ce se știa că vaccinurile NU FAC foarte curând după ce au fost. introdus.
Dacă oamenilor li s-ar spune că vaccinurile ARNm BioNTech/Pfizer sunt „sigure și eficiente” în orice altceva decât prevenirea Covid-19 și dacă ar fi amenințați cu orice consecințe pentru nerespectarea vaccinului pentru orice altceva decât prevenirea Covid-19, ar putea ei au un argument legitim că au fost constrânși ilegal să ia un produs neaprobat în baza unor revendicări frauduloase?
Cerințe de nivel al treilea pentru EUA pentru produse neaprobate
Odată ce avem declarația de urgență specifică EUA și odată ce FDA declară că produsul poate fi eficient și că orice dovezi este disponibilă (de la zero la infinit) arată că beneficiile sale depășesc riscurile (după cum este determinat de ceea ce FDA crede că acestea ar putea) fi), există încă un strat de reglementare care nu are legătură cu siguranța și eficacitatea.
Iată cum a Raportul Serviciului de Cercetare al Congresului din 2018 privind EUA explică asta:
FFDCA §564 ordonă FDA să impună anumite condiții obligatorii într-un EUA și permite condiții suplimentare discreționare, acolo unde este cazul. Condițiile necesare variază în funcție de faptul că EUA este pentru un produs neaprobat sau pentru o utilizare neaprobată a unui produs aprobat. Pentru un produs neaprobat, condițiile de utilizare trebuie:
(1) se asigură că profesioniștii din domeniul sănătății care administrează produsul primesc informațiile necesare;
(2) să se asigure că persoanele cărora le este administrat produsul primesc informațiile necesare;
(3) asigură monitorizarea și raportarea evenimentelor adverse asociate produsului; și
(4) să prevadă evidența și raportarea de către producător.
ÎNTREBARE LEGALĂ: Care sunt exact „informațiile necesare?” Știm că oamenii au fost informați că vaccinurile au primit Autorizație de Utilizare de Urgență. Dar li s-a spus că acest lucru înseamnă „un nivel mai scăzut de dovezi” decât este necesar pentru afirmațiile „sigure și eficiente” privind alte produse medicale? Au fost informați că există diferite niveluri de „sigur și eficient”, în funcție de faptul dacă un produs are EUA sau alt tip de autorizație?
NOTĂ: Legea cere să existe o modalitate de a monitoriza și raporta evenimentele adverse. Cu toate acestea, nu precizează cine monitorizează, care sunt standardele de raportare și care este pragul pentru luarea de măsuri pe baza rapoartelor.
EUA în comparație cu orice altă cale de aprobare a medicamentelor/vaccinurilor
Ca cercetător/scriitor Sasha Latypova a subliniat, mulți oameni au fost confuzi de EUA, deoarece seamănă foarte mult cu EAU, care înseamnă „Expanded Access Use”. Acesta este un tip de autorizare acordată produselor medicale atunci când există o nevoie urgentă de către un anumit grup de pacienți (de exemplu, pacienții cu cancer în stadiul IV a căror speranță de viață este măsurată în luni) care sunt dispuși să riscă evenimente adverse și chiar deces în schimbul accesului. la un tratament experimental.
Autorizarea de utilizare în caz de urgență nu are nicio legătură cu utilizarea accesului extins și nici nu are nicio asemănare cu aceasta.
Diferitele căi legale de autorizare a produselor medicale sunt bine prezentate într-un tabel evidențiat de cercetătorul juridic Katherine Watt. Tabelul face parte dintr-o prezentare din 2020 pentru o sesiune de învățare comună FDA-CDC: Actualizări de reglementare privind utilizarea contramăsurilor medicale.
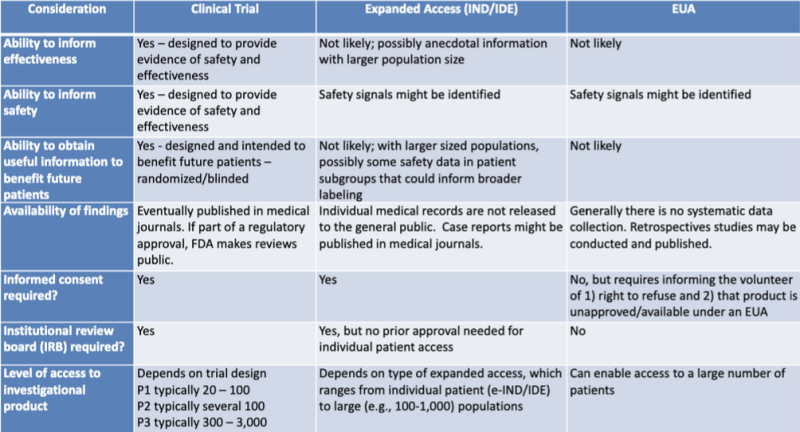
Acest tabel arată foarte clar că este puțin probabil ca procesul EUA să ofere informații cu privire la eficacitatea produsului, nu este conceput pentru a oferi dovezi de siguranță, nu este probabil să ofere informații utile în beneficiul viitorilor pacienți, nu implică colectarea sistematică de date, nu necesită studii retrospective, fără consimțământ informat și fără consiliu de revizuire instituțional.
Mai mult, într-o 2009 Institutul de Medicină al publicaţiei Naţionale Academice, evidențiat și de Watt, intitulat „Medical Countermeasures: Dispensing Emergency Use Authorization and the Postal Model – Workshop Summary” găsim această afirmație la p. 28:
Este important să recunoaștem că un EUA nu face parte din calea de dezvoltare; este o entitate complet separată care este utilizată numai în situații de urgență și nu face parte din procesul de aprobare a medicamentelor.
Înseamnă asta că aprobările contramăsurilor Covid-19 bazate pe EUA au fost ilegale? Înseamnă că nu există nicio modalitate legală de a pretinde că un produs EUA este „sigur și eficient”, deoarece NU FACE PARTEA DIN PROCESUL DE OMOLOGARE A MEDICAMENTULUI?
Concluzie
Este evident, având în vedere toate informațiile din acest articol și din cele precedente Partea 1, că vaccinurile BioNTach/Pfizer Covid ARNm au fost dezvoltate, fabricate și autorizate conform legilor militare rezervate pentru situații de urgență care implică război biologic/terorism, nu boli care apar în mod natural care afectează întreaga populație civilă.
Prin urmare, respectarea reglementărilor și supravegherea pe care ne așteptăm să le găsim atunci când un produs este considerat „sigur și eficient” pentru întreaga populație civilă nu a fost impusă legal.
Poate fi folosită această analiză pentru a contesta legalitatea revendicării „sigure și eficiente” a acelor oficiali guvernamentali care știau ce înseamnă EUA? Există și alte ramificații legale?
Așa sper.
Este important că în provocările legale aduse vaccinurilor ARNm Covid până acum, nu au existat hotărâri (de care sunt conștient) cu privire la dacă legea militară, precum OTA și EUA, poate fi aplicată situațiilor civile. Cu toate acestea, a existat o declarație a judecătorului de la Judecătoria Michael Truncale, în sa respingerea cazului avertizorului Brook Jackson împotriva Ventavia și Pfizer, este important de reținut.
Aici, judecătorul recunoaște că acordul pentru vaccinurile ARNm BioNTech/Pfizer a fost o OTA militară, dar refuză să se pronunțe cu privire la aplicabilitatea acestuia în circumstanțele non-militare (boală naturală, 100 de milioane de doze în mare parte nu pentru uz militar) în care acesta a fost emis:
Faptul că atât personalul militar, cât și civilii au primit vaccinul nu indică faptul că obținerea vaccinului a fost irelevantă pentru creșterea eficienței misiunii militare. Mai important, doamna Jackson cere, de fapt, Curții să anuleze decizia DoD de a exercita alte autorități de tranzacționare pentru a cumpăra vaccinul Pfizer. Dar, așa cum a subliniat de multă vreme Curtea Supremă a Statelor Unite, „deciziile complexe, subtile și profesionale cu privire la alcătuirea, pregătirea, echiparea și controlul unei forțe militare sunt în esență hotărâri militare profesionale”. Gilligan v. Morgan, 413 US 1, 10 (1973). Astfel, este „dificil de conceput un domeniu de activitate guvernamentală în care instanțele au mai puține competențe”. Id. Această Curte nu va pune veto hotărârilor DoD privind eficacitatea misiunii în timpul unei urgențe naționale.
Acesta este doar unul dintre multele obstacole legale care rămân în lupta pentru a interzice în cele din urmă toate produsele ARNm aprobate în timpul urgenței Covid-19 și orice produse ulterioare ARNm a căror aprobare s-a bazat pe procesul de aprobare Covid-19.
Publicat sub a Licență internațională Creative Commons Attribution 4.0
Pentru retipăriri, vă rugăm să setați linkul canonic înapoi la original Institutul Brownstone Articol și autor.









