
În ultimele decenii ale carierei mele, am petrecut nenumărate ore lucrând pentru a proteja americanii prin cercetarea siguranței drogurilor. Educația și cariera mea m-au condus prin aproximativ o jumătate de duzină de universități, Big Pharma și la FDA sub trei administrații prezidențiale. Siguranța medicamentelor ia în considerare de ce o persoană poate lua un produs farmaceutic și poate avea zero evenimente adverse, în timp ce o altă persoană ar putea lua același produs, dar poate avea reacții adverse până la invaliditate permanentă sau deces. În mod implicit, studierea siguranței medicamentelor ia în considerare și aspectele non-clinice ale producției și calitatea medicamentelor.
Deoarece calitatea medicamentelor este un factor esențial în evaluarea siguranței medicamentelor, drumul meu pentru a-i proteja pe americani a condus la conceptualizarea și întemeierea primului "farmacie analitică” misiunea de a verifica științific produsele farmaceutice din locuri precum India și China înainte de a le distribui pacienților. Din nefericire, urmărirea mărimii asupra eticii și protejarea pacienților a dus la angajamentul managementului financiar al acelei companii. extensiv Încălcări ale FDA şi fiind acuzat de judecători că a făcut afirmații științifice false (toate acestea s-au întâmplat întâmplător după ieșirea mea).
Fără o confirmare externă a calității medicamentelor, americanii sunt complet dependenți de FDA și de producători pentru a evalua și confirma puritatea produsului. Siguranța medicamentelor s-a dovedit a fi o problemă demnă de remarcat atunci când vine vorba de injecțiile de ARNm Covid. Din păcate, dacă cineva a vrut să-și efectueze propria analiză asupra injecțiilor de ARNm, ei nu au o listă de ingrediente detaliată în mod corespunzător cu care să o compare, sau chiar acces la metodologia de reglementare stabilită cu privire la modul de testare adecvată a purității..
Este pentru că producătorii și FDA ia în considerare toate ingredientele acestor injecții de ARNm, inclusiv secvența de ARNm plus proprietățile nanoparticulelor lipidice (LNP), inclusiv timpul de înjumătățire, structurile LNP, modificările de suprafață, numărul/tipurile de LNP per doză și punctele de atașare pe catena de ARNm, să fie nespecificată sau „secret comercial”.
În plus, FDA ia în considerare în plus metodologii despre cum se testează injecțiile de ARNm pentru puritate, de asemenea, un secret comercial.
Sprijin bipartizan și sute de miliarde de dolari contribuabililor, dar NU transparență?
Secretul ARNm Covid există chiar dacă atât administrația Trump, cât și administrația Biden au propus o transparență deplină cu injecțiile de ARNm până la ridicarea drepturilor de proprietate intelectuală a ARNm Covid. În ciuda acestui fapt, atât FDA, cât și producătorii permit/păstrează strâns brevetele, inclusiv datele de bază despre aceste fotografii, ca un secret comercial. Ei fac acest lucru, în ciuda faptului că toți producătorii de vaccinuri Covid au primit sute de milioane de dolari contribuabililor în conformitate cu Forbes/Statista publicații.
Studierea epidemiologiei siguranței medicamentelor este destul de dificilă. Fără o puritate/coerență verificabilă a produsului, o evaluare completă a siguranței este imposibilă.
Transparența deplină a tuturor ingredientelor și măsurile de control al calității sunt importante nu numai pentru că au fost finanțate în mare măsură de contribuabili cu sute de milioane de dolari, ci și pentru că au apărut o serie de întrebări cu privire la siguranța și eficacitatea injecțiilor cu ARNm Covid.
Pe lângă faptul că sunt excepțional de complexe, aprobarea lor a fost accelerată de autoritățile de reglementare după mai puțin de un an. De obicei, cele mai multe medicamente și vaccinuri iau în jur zece ani pentru a testa pe deplin siguranța/eficacitatea și a revizui și a aproba. Pe lângă faptul că ingredientele sunt complet noi, foarte complexe și primele de acest gen care sunt administrate la scară masivă, dezvoltarea inclusiv evaluările clinice pe termen lung privind siguranța/toxicitatea și revizuirile epidemiologice au fost accelerate și probabil că nu au fost pe deplin elucidate înainte de eliberare.
Verificarea ingredientelor FDA, transparența și „Adevărul” au precedente datând din anii 1800:
Verificarea analitică și transparența ingredientelor sau „adevărul în etichetare” în cazul în care conținutul sticlei este necesar pentru a se potrivi cu ingredientele enumerate precede înființarea FDA, din 1862. FDA de astăzi s-a născut de fapt din ceea ce a început ca un singur angajat al „Departamentului de Chimie” angajat la Departamentul Agriculturii din SUA.
Alterare, (ingrediente modificate sau toxice) branding greșit (conține o etichetă falsă sau induce în eroare în alt mod sau conține afirmații medicale incorecte) sau etichetare greșită (conține ingredient(e) nu sunt enumerate pe eticheta produsului) au avut toate istorii lungi și urâte în America. Se credea că gravitatea a atins apogeul la începutul până la mijlocul secolului al XIX-lea – sau cel puțin atunci a devenit identificabilă – deoarece abia în 19 au fost dezvoltate procese tehnice pentru a analiza și detecta frauda cu ingrediente. Înainte de aceasta, așa-numiții „mediciști călători” care se numeau „medici” (invariabil cu acreditări dubioase sau inexistente) comercializau sticle de produse „vindecă toate”, ale căror etichete de ingrediente ar enumera doar conținuturi nebuloase sau inofensive, cum ar fi „vitamine""extracte din plante,"Sau"ulei de sarpe” – sau adesea nu au nicio listă de ingrediente.
Pe atunci, mulți devotați, puritani din New England, care din motive religioase ar fi făcut-o nu atinge alcool, ar cumpăra aceste soluții de la acești vânzători ambulanți și, fără să știe, ar fi păcălit să consume soluții care nu numai că conțineau alcool, ci și narcotice precum opiu și/sau cocaină. Sub pretenția de a îmbunătăți o abundență absurdă de afecțiuni, pacienții au dezvoltat în schimb dependență de pedepsire și/sau sănătatea lor a fost afectată în mod negativ de acești „dealeri de droguri” timpurii.
Pe măsură ce problema creștea, guvernul federal a început să ia seama. În cele din urmă, cel Legea pentru alimente și medicamente pure a fost adoptată în 1906 și a condus la crearea Food and Drug Administration (FDA).
[FDA a avut un formativ datoria de a se asigura că medicamentele poartă etichete veridice și îndeplinesc anumite standarde de puritate și putere.
Amintiți-vă că are aproape 120 de ani cerința de etichetare veridică și partea de „puritate” a Actului Pure Food and Drug din 1906, în timp ce citiți despre testarea de verificare a ARNm și transparența ingredientelor.]
Ce teste de verificare a ingredientelor „adevărate” și „pure” au loc pentru produsele reglementate de FDA?
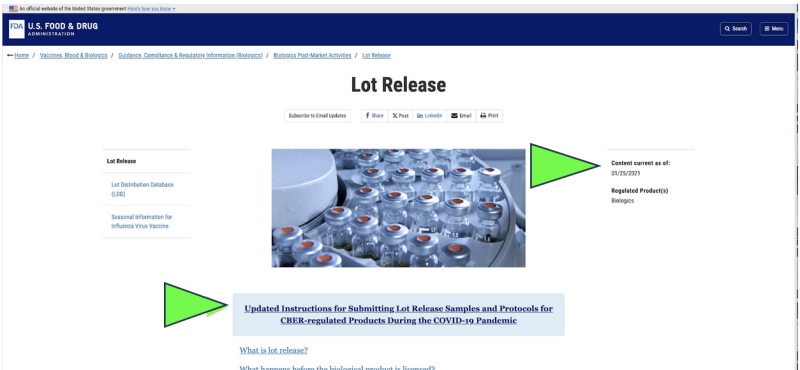
În 2021, FDA a ales să înceapă să monitorizeze calitatea farmaceutică a Americii printr-un colectare la distanță of trimiterea prin poștă a mostrelor pentru medicamente, ca înlocuitor pentru inspecțiile vii la unități din cauza pandemiei de Covid. A fost legal? Ar putea fi vreodată considerat adecvat din punct de vedere științific? Astăzi, în ciuda faptului că pandemia s-a încheiat, singura testare oficială de eliberare farmaceutică se efectuează în prezent Orice Produs farmaceutic ARNm Covid apare la încă să fie făcut de FDA prin intermediul unui furnizor furnizat de producător, „trimis prin poștă” proba conform a captură de ecran a site-ului actual al FDA. Evident, o metodă de eșantionare „trimisă prin poștă” este mult diferită și poate mai puțin fiabilă decât colectarea directă a probelor printr-o metodă de colectare directă, în persoană. În ciuda acestui fapt, FDA susține că are „cel mai înalt standard de pe glob pentru eșantionare și testare. "
În plus, FDA propune să-și avanseze în continuare politica de testare la distanță „transmisă prin poștă” cu a document de orientare nou propus.
Deși există doar ca un „proiect” de document FDA, site-urile web oficiale ale FDA arată asta trimiterea prin poștă a mostrelor pare să fi fost deja implementată cel puțin din ianuarie 2021. FDA pare să afirme rezultatele acestor teste trimise prin poștă ca verificare independentă.
Mai mult decât atât, partea de jos a primei pagini a proiectului FDA documentul propune extinderea „testării la distanță”. În prezent listează fiecare Divizia de reglementare a produselor FDA la FDA, ceea ce sugerează că este o propunere de politică la nivel de agenție.
Lista completă include:
- Biroul pentru Afaceri de Reglementare
- Biroul pentru Politică Alimentară și Răspuns
- Biroul de produse combinate
- Centrul de Evaluare și Cercetare Biologică
- Centrul de evaluare și cercetare a drogurilor
- Centrul pentru dispozitive și sănătate radiologică
- Centrul pentru Siguranța Alimentelor și Nutriție Aplicată
- Centrul pentru produse din tutun
- Centrul de Medicină Veterinară
Este adecvată eșantionarea de control al calității de către FDA „Trimite prin poștă”? Ce se întâmplă dacă inspecțiile la restaurant ale Departamentului de Sănătate al Statelor ar oglindi politica FDA?
Această metodologie de prelevare prin poștă este la fel de absurdă, de exemplu, pentru un departament de sănătate al unui stat care monitorizează restaurantele, cerându-le să „trimeze” periodic diverse articole din meniul lor către o unitate de testare, astfel încât departamentele de sănătate să poată testa alimente potențiale. -contaminarea născută și/sau solicitarea restaurantelor să promită că vor testa singuri elementele din meniu. Dacă acel restaurant ar fi în China? Dacă acel restaurant ar fi în India? Sau orice altă țară despre care se știe că are un istoric abisal de fraudă și control al calității Probleme?
Această metodologie ar fi inacceptabilă atât pentru restaurante, cât și pentru companiile farmaceutice, din motive care includ cele evidente: producătorii ar putea trimite mostrele pe care le preferă – nu neapărat mostre de loturi reprezentative. Evident, nu este același lucru cu inspectorii FDA care achiziționează mostre în timpul inspecțiilor neanunțate ale întregii unități.
Conform analogiei cu restaurantul, desigur că toate restaurantele ar face-o trimite mostre de nota „A”. care nu ar fi neapărat reprezentativ pentru ceea ce primesc consumatorii.

Controlul calității: ce este „testarea de eliberare” farmaceutică și de ce este importantă?
Astăzi, FDA supraveghează calitatea și conținutul $2.7 trilion valoarea produsului anual, dar pare să suprime evaluările și rezultatele verificării ingredientelor critice. Se presupune că FDA îi protejează pe americani prin conducere cuprinzător testarea analitică ca sumă de control pentru a asigura acuratețea ingredientelor. Rezultatele ar trebui să fie transparente pentru contribuabilii care finanțează 6.6 miliarde de dolari ale FDA buget. Această verificare științifică este denumită farmaceutică "testarea lansării.” Testarea de lansare este un termen tehnic care se referă la un proces care implică o varietate de analize instrumentale utilizate cuprinzător testați produsele pentru puritate, concentrație, consistență, identitate și impurități de orice fel.
Întreaga FDA s-a născut din acel singur angajat al „Departamentului de Chimie” din 1862 și din nevoia de transparență și verificare a ingredientelor. Astăzi, acel angajat a proliferat într-un întreg departamentul FDA de 1,300 de oameni de știință și personal de asistență presupus dedicat verificării ingredientelor prin testarea eliberării farmaceutice. FDA-urile Biroul pentru Calitate Farmaceutică (OPQ) trebuie să se asigure că produsele farmaceutice se potrivesc exact cu conținutul ingredientelor enumerate, fără variabilitate de calitate/impuritate (calitativă) sau conținut (calitativă). Regulile care impun acest lucru sunt foarte specifice și detaliate în 21 CFR § 201.10.
Cum verifică FDA injecțiile de ARNm pentru controlul calității:
Rezultatele controlului calității din testele din injecțiile de ARNm au fost deosebit de critice, deoarece sunt mari, complexe și au fost realizate rapid. În timp ce contribuabilii depind de FDA pentru verificarea calității injectării ARNm și pentru a împărtăși rezultatele, FDA pare obligat să protejeze ingredientele producătorilor chiar și în detrimentul celei mai elementare transparențe în ceea ce privește produsele ARNm Covid. În timp ce FDA pare să colecteze mostre, metodologia lor de „trimitere prin poștă” este fundamental defectuoasă. În plus, FDA nu împărtășește rezultatele acelor teste oriunde le-aș putea găsi.
Cu alte cuvinte: în timpul pandemiei, când injecțiile cu ARNm nou-nouțe, implementate pe scară largă, erau impuse americanilor cu „viteză warp” și când America se baza cel mai mult pe obligațiile de calitate/reglementare ale FDA, FDA accepta „trimise prin poștă” auto-depuse. în” teste de control al calității și/sau rezultate. FDA nu a luat în considerare asta Producătorii de ARNm au recunoscut că „luptează[d]” să răspundă la producție și „se chinuie” să țină pasul cu procesele de fabricație? Producătorii de ingrediente ARNm au declarat în continuare că eforturile de a satisface nevoile au fost „fără precedent”.
Declarații ca aceasta nu oferă consumatorilor încredere în calitate și sunt ilustrative pentru extinderea uriașă a acestor produse complexe care ar trebui să garanteze mai ales vigilent și controlul FDA în persoană a instalațiilor și produselor fabricate, pandemie sau nu. Un producător de ingrediente ARNm, de exemplu, a declarat că și-a crescut brusc producția 50 ori.
În mijlocul acelei noi tehnologii împinsă cu „viteza urzeală”, niciunul dintre cei 1,300 de oameni de știință OPQ de la FDA nu a cerut inspecții în direct sau, cel puțin, nu s-a oferit să facă altceva decât să ceară mostre „trimise” potențial îndoielnice. pentru testare?
Întrebarea evidentă este: de ce nu FDA a colectat mostre direct? Chiar și cu pandemia în vigoare, FDA ar fi putut inspecta instalațiile purtând costume pentru substanțe periculoase sau – sau la foarte cel puțin – a optat pentru a colecta mostre de la farmacii, spitale sau la depozitele distribuitorilor.
Metodologie ascunsă pentru testarea ingredientelor injectabile de ARNm:
Dincolo de absența rezultatelor testării și a rezultatelor îndoielnice de eșantionare „trimise prin poștă” – FDA este în plus ascunderea metodologiei lor validate, împiedicând alții să efectueze propriile analize independente privind calitatea/puritatea injecțiilor de ARNm.
Analizarea independentă a medicamentelor pentru puritate și contaminare potențială în comparație cu lista de ingrediente este ceva ce încercasem să fac și eu când am conceptualizat primul farmacie analitică. Cu toate acestea, deoarece injecțiile de ARNm sunt o tehnologie nouă cu o listă de ingrediente mai puțin transparentă, metodologia de testare pe care ar trebui să o folosească nu este simplă, așa cum ar fi pentru alte medicamente cu molecule mici. Oricine încearcă să caute stocarea, stabilitatea, specificitatea, chimia, sensibilitatea sau chiar metodologia de bază pentru validarea testării și/sau rezultatele sunt blocate printr-un raport FDA care conține redactări ridicol de invazive, făcând chiar și cea mai fundamentală înțelegere științifică a modului de evaluare potențial. rezultate sau efectuarea testelor imposibile.
Ca un exemplu vizual impresionant, o singură pagină redactată într-un rezumat mai lung al reglementărilor FDA (prezentat mai jos) face parte dintr-un Documentul paginii 127 (dintre care doar 63 de pagini au fost partajate, iar din acele 63 de pagini, aproximativ 50% au fost redactate) despre cum se evaluează puritatea, concentrația și alte măsuri analitice ale injecțiilor de ARNm.
Acestea Redacții FDA (b)(4). redactări detaliate specificate folosite pentru „protejează secretele comerciale și informațiile comerciale sau financiare confidențiale.” Dar este într-adevăr adecvat să-l etichetăm „comercial” dacă cercetarea/dezvoltarea/produsul a fost finanțat? sute de milioane de dolari contribuabililor?

Fără o listă de ingrediente sau metodologie de testare, este imposibil pentru oricine altcineva din afara FDA sau producătorilor să știe exact cum să verifice produsul alterare (ingrediente modificate sau toxice) sau etichetare greșită (deoarece o listă completă de ingredient(e), inclusiv secvența de nucleotide și configurații de nanoparticule lipidice sunt deosebit de vagi pe eticheta produsului).
Lipsa metodologiei este deosebit de supărătoare, deoarece date noi, preliminare, care utilizează o metodologie independentă au arătat dovezi Contaminarea ADN-ului în injecțiile cu ARNm Covid.
Așadar, dacă o persoană din afara a susținut că a testat și a găsit o impuritate în injecțiile de ARNm și a cerut FDA sau producătorii răspunsul său, ar primi un răspuns care spune ceva de genul:
- Nu ați folosit o metodologie de testare validată/adecvată pentru a ajunge la concluzii și, prin urmare, analizele dumneavoastră sunt invalide.
În acest sens, laboratorul independent ar încerca să solicite metodologia de testare din documentația aprobată de FDA (adică, documentul complet care conține Figura 5) întrebând: „Bine, aș dori să-l testez folosind metodologia aprobată de dvs.; ne spui ce este asta?”
- FDA sau producătorul ar răspunde ceva de genul: „Ceea ce suntem dispuși să dezvăluim despre metodologia folosită, care nu este confidențial, poate fi găsit online sau printr-o solicitare FDA FOIA” …unde s-ar întâlni cu ei următorul document puternic redactat, unde orice semnificație la distanță este acoperită cu redactări (b)(4).
Citind printre rânduri: este evident că atât producătorii, cât și FDA din America nu doresc ca nimeni altul decât ei înșiși să cunoască ingredientele complete sau chiar să testeze injecțiile de ARNm pentru puritate și consistență.
Potrivit oficialilor FDA: Producția farmaceutică este Extrem de Predispus la eroare:
Multe lucrurile pot merge prost – și fac – în timpul procesului de fabricație a produselor farmaceutice. Dincolo de potențialele inconsecvențe cu injecțiile de mRNA/LNP, implică probleme calitative și cantitative fiecare Produs farmaceutic reglementat de FDA. Chiar și Camera și Senatul au recunoscut oficial rapoartele despre eșecul FDA de a asigura lanțul de aprovizionare farmaceutic al Americii. Majoritatea farmaceutica Americii produs consumator-utilizator finaleste produsă peste mări, în țări precum India și China, și alte țări cu costuri reduse de muncă sunt nu bine respectat pentru nivelurile ridicate de control al calității. Registrul Federal este plin de rapoarte despre încălcări la fabricile de producție din India și China.
FDA certifică, de asemenea, aceste plante – inclusiv pe cele cu istoric lung de încălcări – printr-un sistem de „poștă” către FDA? În mod scandalos, răspunsul la întrebare este ceva care ar face foarte inconfortabil pe oricine preocupat de calitatea farmaceutică.
In timp ce Six Sigma Nivelul de precizie a fost mult timp ținta pentru calitate și siguranță în industria de automobile, computere, telefoane mobile și alte produse de înaltă tehnologie, pare să fi fost în mare parte trecută cu vederea atunci când vine vorba de fabricarea farmaceutică.
Oficialii FDA au publicat date care estimează o imprecizie de 2-3σ (sigma) în producția farmaceutică. O calitate 2σ corespunde 308,537 defecte la 1,000,000 de oportunitati. (Există probabil mult mai mult de 1,000,000 de oportunități de eroare atunci când vine vorba de producția de produse farmaceutice.) FDA este conștientă de acest lucru la cele mai înalte niveluri de conducere; de fapt, curentul Șeful Biroului pentru Calitate Farmaceutică al FDA, Michael Kopcha chiar a scris și publicat calculul Six Sigma de mai sus, deplângând natura imprecisă a producției farmaceutice. înapoi în 2017.
Latitudinea de eroare pentru produsele ARNm și/sau LNP-urile lor ar putea fi egală mai puțin precise decât 2-3σ, (cu cât σ este mai mic, cu atât un produs este mai eronat), deoarece includ material nucleotidic și noi LNP-uri, făcându-le substanțial mai complexe decât produsele farmaceutice cu molecule mici - chiar dacă sunt dezvoltate, fabricate și lansate la " viteza warp.”
Chiar și FDA și oficialii săi recunoscând o imprecizie inerentă a producției, de ce în lumea largă a sportului FDA nu își îndeplinește misiunea de siguranță prin împărtășirea publică a testelor sale de lansare a tehnologiei ARNm cu publicul american care le finanțează?
Din nou înainte de 1862? Sunt injecțiile de ARNm singurele medicamente pentru care americanii nu le au? Completa Informații despre ingrediente?
Lipsa de claritate cu privire la numărul de secvențe de injecții de ARNm și alte informații critice este în contrast direct cu un alt medicament pe bază de ARN aprobat de FDA - patisiran (Onpattro®). Onpattro oferă în mod transparent secvența, greutatea moleculară și puterea miligramelor produselor sale în cadrul FDA oficial etichetarea pachetului după cum este ilustrat într-un fragment de mai jos:


Lipsa specificității dozei de ARNm Covid: 0.3 ml (sau 0.5 ml) din ce?
Deocamdată, încă nu avem informații de bază despre ingrediente pentru orice injecție de ARNm Covid. Farmaciştii ştiu doar să dea un anumit volum de fluid și se pare că a făcut-o fără îndoială. În mod normal, etichetarea oficială a ambalajului FDA ar trebui să detalieze ingredientele reale din acel volum, dar nu pentru etichetele ARNm Covid: ele indică pur și simplu 0.3 ml (sau 0.5 ml) ca „Formă de dozare și concentrație”.
În plus, după cum vă poate spune orice elev de liceu, 0.3/0.5 ml este a volum, nu a rezistenţă. Nu cunoaștem detalii cantitative despre ceea ce este conținut în acel 0.3/0.5 ml, cum ar fi: Câte particule LNP? Ce dimensiune/morfologii ale acelor LNP-uri? Câte secvențe de ARNm în acel volum?




Este aceasta ceea ce trece drept suficient de transparent sau „etichetare adevărată” de către FDA?
Extrasul tăiat și lipit de mai sus din prospectul de pe ambalaj este toate informațiile pe care producătorii le împărtășesc consumatorilor cu privire la doză – care este jalnic inadecvată în comparație cu toate celelalte etichete FDA – sau oricui este curios să știe ceva în afară de cantitatea de lichid. pentru a injecta și concentrația de 30 sau 100 mcg a unei secvențe de ARNm nespecificate.
Imprecizia remarcabilă a acestei etichete permisă de FDA pare să intre în conflict cu eticheta sa veche de aproape 120 de ani: „cerând ca alimentele și medicamentele să poarte etichete veridice și să îndeplinească anumite standarde de puritate și putere. "
Este aceasta ceea ce trece drept o listă „adevărată” de ingrediente de către FDA? (Vedea 21CFR §352, și 21 CFR §201.10 referitor la „declarația ingredientelor” și „medicamentele și dispozitivele greșite.”
Întrebarea este: se listează ingrediente necunoscute sau nespecifice pe care nimeni, cu excepția producătorului, nu le poate descifra într-adevăr respectă spiritul sau cerințele legale de „etichetare?” Este această etichetă ceea ce este considerat „adevărat” de FDA din America? Oricum, de partea cui este FDA; producători sau consumatori?
Pe lângă faptul că nu este specificat direct, numărul exact de catenele LNP sau mARN într-o injecție de 30 sau 100 mcg nici măcar nu poate fi extrapolat stoichiometric sau pe baza de Numărul lui Avogadro, deoarece secvența ARNm, greutatea moleculară și/sau componenta/configurațiile LNP nu sunt furnizate nicăieri în etichetarea oficială FDA.
Cum poate cineva să știe dacă numărul de catene de ARNm care codifică proteina spike pentru Covid este proporțional cu încărcătura de inocul Covid pe care ar fi primit-o de la o infecție dobândită în comunitate? Răspuns: nu pot.
Sunt injecții de ARNm Covid Etichetat corespunzător/etichetat greșit?
21 211.125 CFR specifică „Se exercită un control strict asupra etichetării emise pentru utilizare în operațiunile de etichetare a produselor medicamentoase,” dar se pare că FDA a fost atât de laxă cu etichetarea aprobată a injecțiilor de ARNm Covid, în ciuda faptului că orice alt medicament – inclusiv Onpattro bazat pe ARNm – specifică această informație. Din punct de vedere istoric, deciziile de reglementare ale FDA (cum ar fi informațiile care trebuie incluse în etichetarea produsului) se bazează pe precedență, iar injecțiile de ARNm Covid au fost o abatere evidentă de la precedența istorică și legală a FDA. Acea absență demn de remarcată a datelor și lipsa de claritate amintesc de vremurile Ficatul și rinichiul lui Morley Cordial la sfârşitul anilor 1800. Diferența este: pe atunci, FDA nu exista, dar astăzi există o FDA cu ~ 20,000 de angajați, dintre care cel puțin unii credeau aparent că această etichetă este transparentă și „adevărată”.
Declararea unui ingredient necunoscut/indescifrabil/obscur pe care nimeni nu l-ar putea determina cu exactitate probabil nu este ceea ce au intenționat legislatorii din 1906 Pure Food and Drug Act atunci când au specificat regulile FDA privind „etichetarea veridică”. Separat de asta: faptul că dozele sunt dublate pe volum de la diferiți producători (30 mcg/0.3 ml vs 100 mcg/0.5 ml) înseamnă că aceste secvențe de ARNm par a fi foarte diferite în ceea ce privește lungimea nucleotidelor și, la rândul lor, ar fi mai multe și diferite LNP-uri plus atașamente. Înseamnă asta că secvențele de ARNm folosite pentru a transcrie proteina de vârf au aproximativ două dimensiuni (10mcg/0.1mL față de 20mcg/0.1mL) în comparație cu diferiți producători sau altceva contribuie la diferența de lungime a nucleotidelor?
Pentru profanul care încă citește până în acest punct (felicitari, apropo): Lipsa informațiilor detaliate de etichetare ar putea fi ca și cum ai face reclamă generală pentru o casă de vânzare, afirmând că este făcută din lemn și cărămizi, pe o placă de ciment - dar fără a arăta orice imagini ale casei (de exemplu, secvența) și care nu-și partajează metraje pătrate (de exemplu, greutatea moleculară). În orice caz, lipsa de informații este inadecvată și o abatere de la standardele tradiționale.
Fiecare alt medicament aprobat de FDA - inclusiv alte medicamente ARNm - conține dezvăluiri complete despre ingredientele produselor lor, inclusiv o reprezentare structurală și greutate moleculară a produsului lor, astfel încât oamenii să știe exact ce primesc.
Este adevărat: căutați orice medicament la care vă puteți gândi în Baza de date Drugs.com și observați cum toate etichetele oferă structură și/sau greutate moleculară. Dovada că vaccinurile cu mRNA Covid sunt a evident excepție de la practica istorică de aprobare a FDA și de la regula „etichetei adevărate”.
Studiul danez din 2023 detaliază o variabilitate clinică semnificativă între loturile de injecții de mRNA Covid-19:
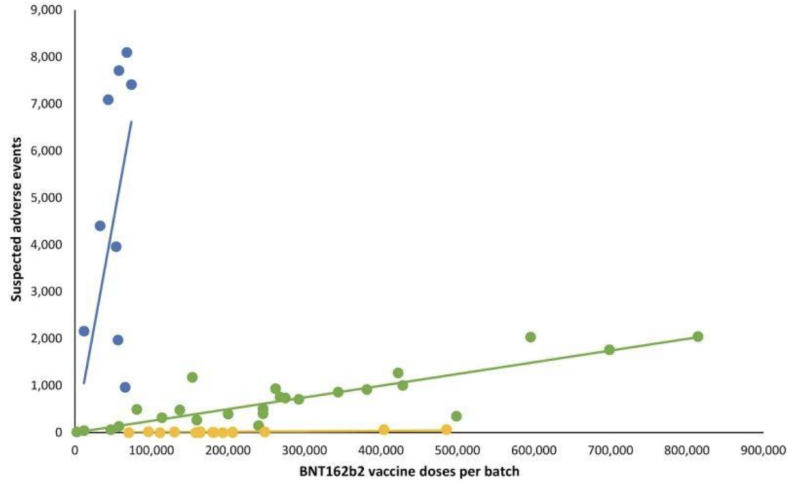
Lipsa de transparență chiar și în ceea ce privește validarea testelor „trimite prin poștă” potențial invalide pare să fi dat producătorilor o trecere asupra unei alte părți extrem de importantă a ceea ce supraveghează FDA: potențialele manifestări clinice ale variațiilor lotului/lotului de injecții ARNm. O retrospectivă Studiu danez de siguranță publicat la începutul anului 2023, a detaliat un model extrem de deviant al rapoartelor de evenimente adverse din injecțiile de ARNm Pfizer-BioNTech BNT162b2, corelate cu sistemul danez de raportare a evenimentelor adverse DKMA.
În graficul de linii care urmează, punctele colorate diferite reprezintă loturi diferite de injecții de ARNm Pfizer-BioNTech. A separat loturile în trei categorii diferite; număr mare-scăzut până la (aproape) absent de grupuri de evenimente adverse raportate (grafice albastre, verzi și, respectiv, galbene).
Cu alte cuvinte: Produsele presupus „echivalente” de la același producător par să aibă incidențe extrem de diferite ale evenimentelor adverse, în funcție de lot, fiecare dintre aceste loturi reprezentând sute de mii de injecții de ARNm.
Când au fost adăugate linii de regresie liniară corespunzătoare, a apărut un anumit model:
Întrebările importante despre disparitatea remarcabilă a evenimentelor adverse dintre loturile de ARNm Covid-19 includ:
- Ar putea variațiile evenimentelor adverse să se datoreze variațiilor calitative sau cantitative ale secvențelor de ARNm sau ale numărului de catene de ARNm între loturi?
- Ar putea variațiile evenimentelor adverse să se datoreze variațiilor calitative sau cantitative ale mărimii/morfologiilor sau cantității de LNP între loturi? La ce teste au fost efectuate asigura siguranța diferitelor LNP-uri utilizat în injecțiile de ARNm?
- Au fost acele loturi care au corespuns cu punctele de date galbene versus verde versus albastre cumva diferite calitativ sau cantitativ?
- Depozitarea/manipularea post-fabricare a fost compromisă la unitatea de administrare (sau în altă parte de-a lungul lanțului de aprovizionare) ducând la variabilitatea produsului?
- Care este rata de eroare/Sigma a acestui produs și a altor produse care provin de la o anumită unitate de producție/șeful de tură responsabil cu producția?
- Au fost ingredientele din aceste produse ARNm Covid provenite din India sau China față de alte părți, în funcție de lot?
- Ce procente de loturi de produse ARNm Covid au fost testate prin colectare în persoană de către un inspector FDA față de „trimiterea prin poștă” de la început până în prezent? Fiecare lot a fost testat folosind doar oricare dintre aceste două metode de colectare?
- A efectuat FDA verificarea testării eliberării pe loturile sistemelor daneze de raportare a evenimentelor adverse DKMA? Dacă da, de ce FDA nu eliberează acele rezultate specifice de testare? Dacă nu, de ce nu s-a făcut testarea?
- Există o problemă fundamentală cu producerea constantă a secvențelor de LNP și/sau ARNm în mod fiabil și fără contaminare?
Rezultatele studiului danez și întrebările de mai sus despre evenimentele adverse ar putea *începe* să fie abordate, dar nu fără ca FDA să împărtășească în mod independent rezultatele rezultatelor testelor de eliberare. În starea actuală, din cauza redacțiilor omniprezente ale FDA (b)(4), nimeni nu cunoaște metodologia validată pentru testarea vaccinurilor cu ARNm Covid. or exact ce loturi din studiul danez au fost sau nu au fost testate or rezultatele acestor teste pe lot.
… Din nou, chiar dacă FDA ar fi ales să elibereze acele rezultate ale testelor pe lot, de unde știu consumatorii dacă acele rezultate sunt reprezentative pentru loturile specificate, deoarece producătorii selectează singuri ce mostre să „trimite prin poștă?”
Neasigurarea transparenței ingredientelor și asigurarea calității printr-o metodologie de eșantionare adecvată este o cerință fundamentală și de bază a FDA. De fapt, acesta a fost motivul principal pentru formarea FDA! Nu merită americanii o mai bună transparență, supraveghere și legi privind „etichetarea adevărată” atunci când vine vorba de produsele noastre farmaceutice – mai ales că acele legi au fost făcute cu peste 100 de ani în urmă?
Publicat sub a Licență internațională Creative Commons Attribution 4.0
Pentru retipăriri, vă rugăm să setați linkul canonic înapoi la original Institutul Brownstone Articol și autor.









