În timpul pandemiei de Covid, guvernul SUA a cheltuit miliarde de dolari pentru aproape 400 de produse destinate să protejeze, să diagnosticheze și să trateze sute de milioane de oameni – toate cu eticheta „EUA” sau „Autorizare de utilizare de urgență”.
Dar ce înseamnă de fapt EUA?
Chiar înainte de a răspunde la această întrebare și pentru a înțelege unde se află EUA în relație cu alte căi de autorizare sau aprobare a produselor medicale, este util să ne uităm la ce nu este EUA:
EUA nu este o denumire pentru un produs experimental supus unui studiu clinic
Dacă înțelegem un singur lucru despre EUA, acesta ar trebui să fie acesta: EUA nu se aplică unui produs supus unui studiu clinic guvernat de reglementările FDA sau de alte cerințe legale.
EUA nu este, de asemenea, același lucru cu Expanded Access Use (EAU), adesea numit acces „utilizare compasiune”, care se aplică la acordarea pacienților cu boli severe, incurabile, acces la produse experimentale înainte ca acestea să fie pe deplin aprobate.
Acest tabel de la un Prezentare FDA-CDC 2020 rezumă diferențele dintre produsele supuse unor studii clinice, produsele oferite pacienților prin acces „compasional” extins și produsele autorizate prin EUA:
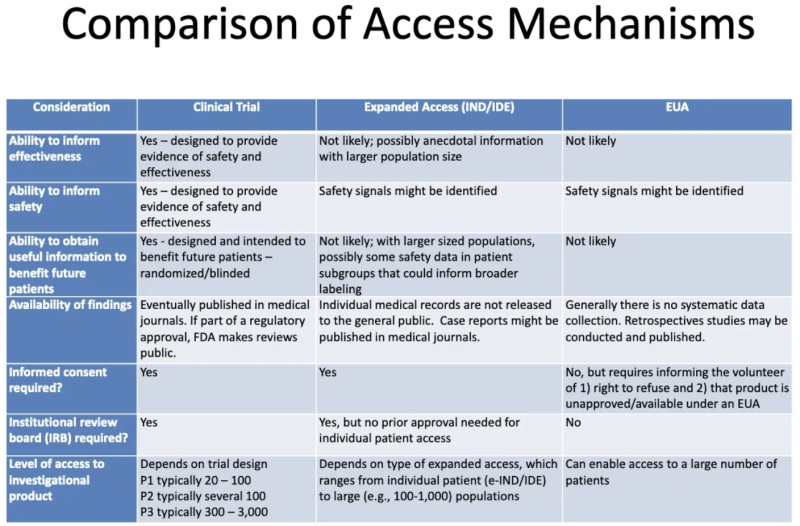
Iată ce ne spune acest tabel despre EUA:
- Procesul de acordare a EUA nu este de natură să genereze informații despre eficacitatea unui produs.
- Procesul de acordare a EUA nu este conceput pentru a oferi dovezi de siguranță sau eficacitate, dar semnalele de siguranță ar putea fi identificate.
- Este puțin probabil ca, odată ce unui produs i se acordă EUA și este administrat unor pacienți, orice informații utile vor fi obținute în beneficiul oricăror viitori pacienți.
- Nu există o colectare sistematică de date privind eficacitatea sau siguranța cu EUA și nu sunt publicate date în reviste medicale ca parte a procesului de aprobare de reglementare.
- Nu este necesar consimțământul informat, dar pacienților care se „voluntare” să ia produsul trebuie să li se spună că pot refuza și că produsul nu este aprobat/disponibil conform EUA.
- Nu este necesar un comitet de revizuire instituțional (IRB). [IRB este un consiliu care ar trebui să protejeze bunăstarea subiecților umani în studiile clinice]
Pentru a clarifica și mai mult cât de separată este EUA de orice proces normal de aprobare, în a 2009 Publicația Institutul de Medicină al Academiilor Naționale, găsim această afirmație:
Este important să recunoaștem că un EUA nu face parte din calea de dezvoltare; este o entitate complet separată care este utilizată numai în situații de urgență și nu face parte din procesul de aprobare a medicamentelor. (pag. 28)
Pentru a rezuma:
Procesul de acordare a unui produs EUA este puțin probabil să genereze vreo dovadă de siguranță sau eficacitate. Odată ce unui produs i se acordă EUA și este administrat pacienților, este puțin probabil ca informații utile să fie obținute în beneficiul viitorilor pacienți, deoarece nu există o colectare sistematică de date privind eficacitatea sau siguranța.
Pe baza tuturor acestor informații foarte clare de la CDC/FDA și IMNA, ar fi corect să concluzionăm că Autorizarea de utilizare de urgență este un proces care ar trebui aplicat foarte judicios și numai în cazuri de urgențe grave.
Acum să ne uităm la ce tipuri de situații de urgență este proiectată legal să abordeze EUA.
EAU este destinat situațiilor de urgență cu ADM
Legile care permit „Mecanismul de acces” EUA descris mai sus au fost elaborate pentru cazuri de urgențe extreme, imediate, care implică arme de distrugere în masă (ADM), denumite și agenți CBRN (chimici, biologici, radiologici, nucleari).
Iată cum Administrația pentru Alimente și Medicamente (FDA) își descrie puterile EUA:
Secțiunea 564 din Legea FD&C (21 USC 360bbb – 3) permite FDA să consolideze protecția sănătății publice împotriva agenților biologici, chimici, nucleari și radiologici.
Cu această autoritate EUA, FDA poate ajuta să se asigure că pot fi utilizate contramăsuri medicale în situații de urgență pentru a diagnostica, trata sau preveni boli sau afecțiuni grave sau care pun viața în pericol cauzate de agenți biologici, chimici, nucleari sau radiologici atunci când nu există adecvați, aprobați. , și alternativele disponibile (printre alte criterii).
Aceste competențe EUA au fost acordate în 2004 în circumstanțe foarte specifice legate de pregătirea pentru atacuri ale agenților CBRN.
Așa cum am explicat în Bill of Health al Legii Harvard,
În cele din urmă, războiul împotriva terorii a fost cel care va da naștere autorizației de utilizare în caz de urgență. După evenimentele din 11 septembrie 2001 și atacurile ulterioare prin poștă cu antrax, Congresul a adoptat Proiectul Bioshield Act din 2004.
record indică faptul că Congresul sa concentrat pe amenințarea bioteroarei, nu pe pregătirea pentru o pandemie naturală.
Având în vedere un tip atât de restrâns de situație de urgență cu adevărat extremă, care implică un atac cu arme de distrugere în masă, este de înțeles de ce „mecanismul de acces” EUA nu necesită multă supraveghere reglementară sau aderență la standardele de producție sau de studii clinice.
Deci, ce necesită de fapt mecanismul de acces EUA?
Cei 3 pași pentru autorizarea de utilizare în caz de urgență (EUA)
Trei lucruri trebuie să se întâmple pentru ca EUA să fie acordată unui produs medical:
- Secretarul Securității Interne, Secretarul Apărării sau Secretarul Sănătății și Serviciilor Umane trebuie să stabilească că există o urgență care implică un atac sau amenințarea unui atac cu un agent CBRN sau o boală cauzată de un astfel de agent.
- FDA trebuie să se asigure că îndeplinește patru „criterii statutare” atunci când emite EUA.
- FDA trebuie să „impune anumite condiții obligatorii” în EUA.
EUA Pasul 1: Declararea unei urgențe CBRN
Declarația de urgență pentru EUA este separată și nu are legătură cu orice alte declarații de urgență care pot fi emise de către președinte, secretarul HHS sau oricine altcineva. Acesta trebuie să fie emis special în scopul activării EUA și poate fi încheiat sau extins independent de orice altă declarație de urgență.
Iată ce legea EUA prevede sunt cele patru scenarii posibile pentru activarea „mecanismului de acces” EUA:
- o determinare a Secretarului pentru Securitate Internă că există o urgență internă sau un potențial semnificativ pentru o urgență internă, care implică un risc crescut de atac cu un agent sau agenți biologici, chimici, radiologici sau nucleari;
- o determinare a Secretarului Apărării că există o urgență militară sau un potențial semnificativ pentru o urgență militară, care implică un risc crescut pentru Unit Statele forțele militare, inclusiv personalul care operează sub autoritatea titlului 10 sau a titlului 50, de atac cu—
- un agent sau agenți biologici, chimici, radiologici sau nucleari; sau
- un agent sau agenți care pot cauza sau sunt asociate în alt mod cu un risc iminent care pune viața în pericol și specific pentru United Statele forțele militare;
- o determinare a Secretar [de Sănătate și Servicii Umane] că există o urgență de sănătate publică sau un potențial semnificativ pentru o urgență de sănătate publică, care afectează sau are un potențial semnificativ de a afecta securitatea națională sau sănătatea și securitatea Unit Statele cetățeni care locuiesc în străinătate și care implică un agent sau agenți biologici, chimici, radiologici sau nucleari sau o boală sau afecțiune care poate fi atribuită unui astfel de agent sau agenți; sau
- identificarea unei amenințări materiale în conformitate cu secțiunea 319F–2 din Legea Serviciului de Sănătate Publică [42 USC 247d–6b] suficient pentru a afecta securitatea națională sau sănătatea și securitatea Unit Statele cetăţenii care locuiesc în străinătate.
EUA Pasul 2. Îndeplinirea criteriilor statutare
Odată ce unul dintre secretari a declarat că există o urgență care justifică EUA, mai sunt patru „criterii statutare” care trebuie îndeplinite pentru ca FDA să emită EUA. Iată cum explică FDA aceste cerințe:
- Boală sau afecțiune gravă sau care pune viața în pericol
Pentru ca FDA să emită un EUA, agentul (agentii) CBRN la care se face referire în declarația EUA a secretarului HHS trebuie să fie capabil să provoace o boală sau o afecțiune gravă sau care pune viața în pericol.
- Dovezi de eficacitate
Produsele medicale care pot fi luate în considerare pentru un EUA sunt cele care „pot fi eficiente” pentru a preveni, diagnostica sau trata boli sau afecțiuni grave sau care pun viața în pericol, care pot fi cauzate de un(i) agent(i) CBRN identificat(i) în declarația secretarului HHS de urgență sau amenințare de urgență conform secțiunii 564(b).
Standardul „poate fi eficient” pentru EUA oferă un nivel mai scăzut de dovezi decât standardul de „eficacitate” pe care FDA îl utilizează pentru aprobările produselor. FDA intenționează să evalueze potențiala eficacitate a unui posibil produs EUA de la caz la caz, folosind o analiză risc-beneficiu, așa cum este explicat mai jos.
[FAPA ADAUGATA IN GRADATE]
- Analiza risc-beneficiu
Un produs poate fi luat în considerare pentru un EUA dacă Comisarul stabilește că beneficiile cunoscute și potențiale ale produsului, atunci când este utilizat pentru a diagnostica, preveni sau trata boala sau starea identificată, depășesc riscurile cunoscute și potențiale ale produsului.
Pentru a determina dacă beneficiile cunoscute și potențiale ale produsului depășesc riscurile cunoscute și potențiale, FDA intenționează să se uite la totalitatea dovezilor științifice pentru a face o determinare globală risc-beneficiu. Asemenea dovezi, care ar putea apărea dintr-o varietate de surse, poate include (dar nu se limitează la): rezultate ale studiilor clinice interne și străine, date de eficacitate in vivo de la modele animale și date in vitro; disponibile pentru luarea în considerare a FDA. FDA va evalua, de asemenea, calitatea și cantitatea dovezi disponibile, având în vedere starea actuală a cunoștințelor științifice.
[FAPA ADAUGATA IN GRADATE]
- Fără alternative
Pentru ca FDA să emită un EUA, nu trebuie să existe o alternativă adecvată, aprobată și disponibilă la produsul candidat pentru diagnosticarea, prevenirea sau tratarea bolii sau afecțiunii. Un produs alternativ potențial poate fi considerat „indisponibil” dacă nu există rezerve suficiente de alternativă aprobată pentru a satisface pe deplin nevoia de urgență.
EUA Pasul 3. Impunerea condițiilor obligatorii
Odată ce avem declarația de urgență specifică EUA și odată ce FDA stabilește că produsul poate fi eficient și că orice dovezi disponibile arată că beneficiile sale depășesc riscurile, există încă un nivel de reglementare aferentă.
Iată cum a Raportul Serviciului de Cercetare al Congresului din 2018 privind EUA explică asta:
FFDCA §564 ordonă FDA să impună anumite condiții obligatorii într-un EUA și permite condiții suplimentare discreționare, acolo unde este cazul. Condițiile necesare variază în funcție de faptul că EUA este pentru un produs neaprobat sau pentru o utilizare neaprobată a unui produs aprobat. Pentru un produs neaprobat, condițiile de utilizare trebuie:
(1) se asigură că profesioniștii din domeniul sănătății care administrează produsul primesc informațiile necesare;
(2) să se asigure că persoanele cărora le este administrat produsul primesc informațiile necesare;
(3) asigură monitorizarea și raportarea evenimentelor adverse asociate produsului; și
(4) să prevadă evidența și raportarea de către producător.
Concluzie
După cum s-a menționat în acest articol, FDA/CDC recunosc în mod clar că procesul de acordare a autorizației de utilizare de urgență (EUA) este puțin probabil să genereze informații despre eficacitatea sau siguranța unui produs. Când ne uităm la litera legii care guvernează EUA, vedem că aceasta este, într-adevăr, o evaluare corectă.
Legea EUA nu impune niciun standard legal sau de reglementare care ar putea determina dacă un produs este sigur sau eficient. Singurele standarde sunt dacă FDA consideră că produsul poate fi eficient și că beneficiile sale cunoscute depășesc daunele cunoscute. Dacă nu există daune sau beneficii cunoscute, deoarece produsul nu a trecut niciodată prin procesul de aprobare a medicamentelor, FDA poate utiliza orice informații sau standarde pe care le alege pentru a face această determinare.
Din toate acestea rezultă că o companie al cărei produs este candidat pentru EUA poate încerca să demonstreze siguranța și/sau eficacitatea produsului prin orice mijloace pe care le alege. Existența unei astfel de încercări (indiferent dacă este un studiu clinic sau alt mecanism de colectare a datelor) și modul în care este efectuată această încercare, depinde de companie. Nimic din legea EUA nu se aplică modului în care compania proiectează, efectuează sau analizează orice studii sau alte mecanisme de colectare a datelor pe care alege să le urmeze.
Aplicat produselor Covid, aceasta înseamnă:
- Nu au fost necesare date de siguranță sau eficacitate din studiile clinice pentru ca produsele Covid să primească EUA.
- Orice studii clinice la care se face referire în procesul EUA au fost efectuate fără standarde de reglementare aplicabile din punct de vedere legal.
- Când aflăm că aceste produse nu au eficacitate sau siguranță, nu este o surpriză. Este un rezultat foarte probabil al procesului.
- Nu există date din procesul EUA pe care să se bazeze deciziile non-EUA cu privire la siguranța sau eficacitatea produsului. Deci, orice utilizare a produsului în afara UE ar necesita trecerea de la început a procesului de aprobare legală pentru produsele medicale obișnuite.
Mai multe despre procesul de aprobare a vaccinurilor Covid aici.
Republicat de la autor Substive
Publicat sub a Licență internațională Creative Commons Attribution 4.0
Pentru retipăriri, vă rugăm să setați linkul canonic înapoi la original Institutul Brownstone Articol și autor.









