Site-ul web V-safe al Centrului pentru Controlul și Prevenirea Bolilor (CDC) a încetat în liniște să colecteze rapoarte de evenimente adverse fără niciun motiv sau explicație. Site-ul V-safe pur și simplu Statele: "Vă mulțumim pentru participare. Colectarea datelor pentru vaccinurile COVID-19 s-a încheiat la 30 iunie 2023.” Dacă mergeți acolo astăzi, V-safe direcționează utilizatorii către site-ul web VAERS al FDA pentru raportarea evenimentelor adverse, chiar dacă oficialii au luat în derâdere VAERS ca fiind „pasiv” și „neverificat”.

VAERS și V-safe sunt baze de date de colectare a siguranței care se exclud reciproc, operate de FDA și, respectiv, CDC. VAERS este o modalitate mai veche de colectare a datelor de siguranță în care se poate completa un formular online sau manual sau apelând la un număr gratuit, în timp ce V-safe este o „aplicație” pentru dispozitiv care necesită înregistrare online. Atât VAERS, cât și V-safe colectează informații personale, numere de lot, date și informații asociate, dar V-safe a fost un sistem de colectare activ orientat către un grup demografic mai tânăr care folosește aplicații.
Iată ultimul raport înainte de ștergere.
Înseamnă asta că CDC consideră că injecțiile cu ARNm Covid-19 sunt atât de sigure, încât nu mai este nevoie să monitorizezi rapoartele de evenimente adverse? Care este argumentul împotriva monitorizării continue, mai ales că site-ul web V-safe era deja deschis și plătit?
În timp ce CDC-ul V-safe a fost oprit pe furiș și brusc, refuzând să accepte noi rapoarte de siguranță, până în ziua de azi CDC continuă să îndemne pe toți cei cu vârsta de 6 luni și peste să rămână. până la data de cu vaccinuri și rapeluri COVID-19.
În calitate de expert în siguranța medicamentelor, personal nu pot cita un alt exemplu în care vreo agenție sau producător a oprit colectarea de date privind siguranța. Pare și mai rău, deoarece tehnologia ARNm este relativ nouă, cu manifestări pe termen lung necunoscute. Deasupra acesteia, atât producătorii, cât și FDA refuză să împărtășească il lista de ingrediente, cum ar fi nanoparticulele lipidice, care ar putea afecta indivizii diferit și ar putea dura mult timp pentru a se manifesta clinic.
Colectarea datelor de siguranță nu ar trebui să se oprească niciodată
Acum, contrastați cu faptul că Administrația Națională pentru Trafic și Siguranță pe Autostrăzi (NHTSA) va accepta în continuare un raport de siguranță pentru un Ford Bronco II de 30 de ani. Într-adevăr, acesta este un exemplu ciudat de specific, dar numai pentru că am condus acest vehicul exact ca o familie, ca student, prin rezidența mea, prin bursa, pentru mandatul meu de Yale profesor pe străzile medii din New Haven și chiar în anii mei petrecuți la FDA ca ofițer medical/analist medical superior.
La fel ca injecțiile de ARNm, Bronco II sunt încă disponibile pe piață și oamenii încă le folosesc până în ziua de azi. My Bronco a devenit un subiect intermitent de conversație cu prietenii și colegii FDA. Într-o zi, am fost informat de un agent de pază de la FDA că era cea mai veche mașină din campus.
Nu știam prea multe despre mașini (sau tehnologia ARNm) pe atunci, dar când un coleg FDA-er m-a informat că Bronco II a avut de remarcat probleme de siguranta și că NHTSA încă avea ochii pe acest vehicul (accidentele de răsturnare erau mai frecvente și mai fatale) am abordat problema: am scăpat de relicva de încredere, deși am într-adevăr plăcut aceasta.
NHTSA încă acceptă rapoarte de siguranță cu privire la lucruri precum Ford Bronco II, în vârstă de 30 de ani, dar CDC nu acceptă noi rapoarte de siguranță privind noile vaccinuri ARNm vechi de 2 ani.

CDC nu mai acceptă rapoarte de siguranță, în ciuda constatărilor de siguranță în creștere rapidă:
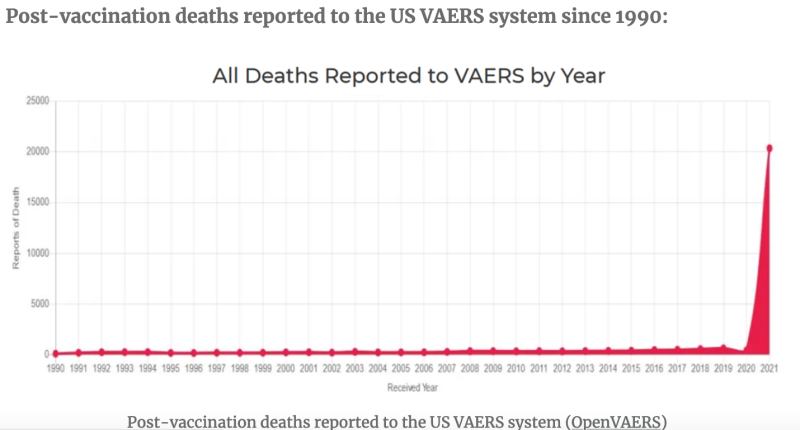
Spre deosebire de vechiul meu Bronco, injecțiile de ARNm au fost pe piață doar de aproximativ Două ani și, conform bazei de date FDA Vaccine Adverse Event Reporting System (VAERS), „vaccinurile” ARNm au fost denumite primar suspect în peste 1.5 milioane de rapoarte de evenimente adverse, dintre care există >20,000 de atacuri de cord și >27,000 de cazuri de miocardită și pericardită doar în SUA. Cifrele la nivel mondial ar fi mai mari. Potrivit multor referințe, inclusiv un studiu finanțat de FDA de la Harvard, Rapoartele VAERS reprezintă mai puțin de 1% dintre evenimentele adverse ale vaccinului care apar efectiv.
Interesant este faptul că Link NHTSA de mai sus pe Ford Bronco II meu arată doar: unu rechemarea pieselor, unu investigație și 23 de reclamații și încă mai are un buton în colțul din dreapta sus pentru depunerea de noi reclamații.
Wikipedia definește un criză umanitară sau dezastru umanitar ca: „eveniment singular sau o serie de evenimente care sunt amenințătoare în ceea ce privește sănătatea, siguranța sau bunăstarea unei comunități sau a unui grup mare de oameni”. Pe baza VAERS și a constatărilor anterioare V-safe, evenimentele adverse de la injecțiile de ARNm numai în SUA ar putea fi considerate o criză umanitară.
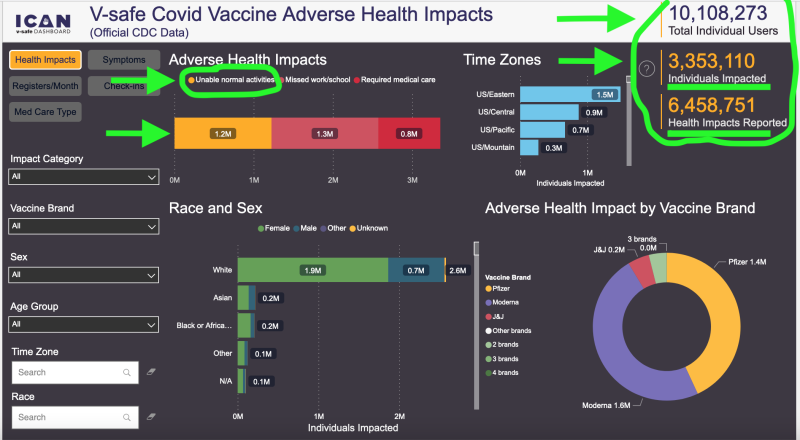
În ciuda acestor constatări clinice alarmante, CDC a concluzionat că colectarea de noi rapoarte de siguranță nu mai este cumva în interesul sănătății publice a Americii. Datele existente de pe site-ul V-safe au arătat în jur 6.5 milioane de evenimente adverse/impacte asupra sănătății din 10.1 milioane de utilizatori, cu aproximativ 2 milioane dintre acești oameni incapabili să desfășoare activități normale ale vieții de zi cu zi sau au nevoie de îngrijiri medicale, potrivit unei terțe părți a constatărilor sale. Cu alte cuvinte, în ciuda faptului că injecțiile de ARNm sunt încă disponibile pe scară largă și CDC-ul promovează utilizarea în continuare, este „cazul închis” în ceea ce privește colectarea de noi rapoarte de siguranță, sub administrația federală de sănătate publică de astăzi.
CDC va opina asupra datelor existente sau va justifica oprirea colectării de noi date de siguranță? Din câte știu, oprirea colectării de informații de sănătate publică nu are o justificare clinică sau o prioritate științifică – mai ales când vine vorba de un produs comercializat activ.
În George Orwell 1984, personajelor li s-a spus de Partid să „respinge dovezile ochilor și urechilor tale”. Acum, CDC nici măcar nu permite ca aceste dovezi să fie colectate pentru vizionare (și respingere potențială). Este o idee groaznică pentru Orice produs, să nu mai vorbim de noi tehnologii ARNm.
Publicat sub a Licență internațională Creative Commons Attribution 4.0
Pentru retipăriri, vă rugăm să setați linkul canonic înapoi la original Institutul Brownstone Articol și autor.









