Telegraph a raportat recent că publicului i s-a spus să înceteze să mai ia medicamente împotriva tusei și răcelii din cauza temerilor legate de siguranță cu privire la medicament, folcodina, un opioid pentru suprimarea tusei.
Douăzeci dintre medicamentele obișnuite pentru tuse și răceală, inclusiv capsule pentru asistentă de zi și de noapte, au fost retrase de urgență de pe piață, la ordinul autorităților de reglementare a medicamentelor, din cauza îngrijorărilor cu privire la un risc „foarte rar” de anafilaxie, un eveniment advers care pune viața în pericol.
Anunțul „Rechemarea medicamentelor de clasa 2” preluat de la guvernul Regatului Unit , este prezentat mai jos.

Când vine vorba de vaccinurile ARNm COVID-19, standardele duble de reglementare nu au fost niciodată atât de evidente.
Anafilaxia a fost identificată ca un risc important de către Agenția Europeană pentru Medicamente, încă din decembrie 2020, în cadrul CHMP (Comitetul pentru produse medicamentoase de uz uman) al EMA. raport de evaluare privind vaccinul Pfizer-BioNTech COVID-19, văzut mai jos.
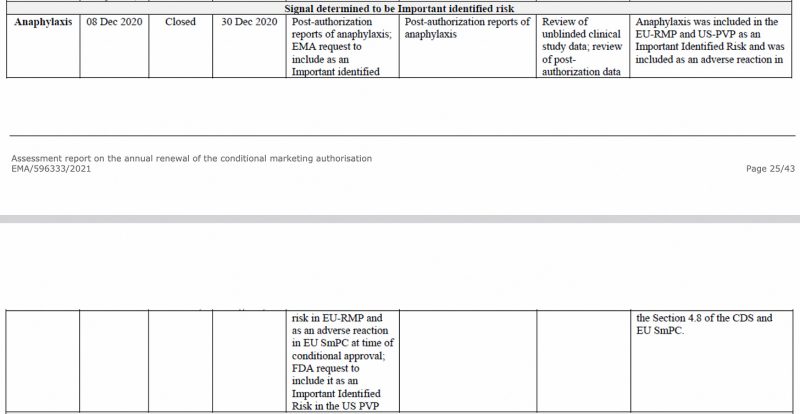
De asemenea, în prima actualizare periodică de siguranță a UE Raport, pe care l-am avut anterior analizate, anafilaxia a fost din nou semnalată ca un risc important identificat.

În acest raport de farmacovigilență au fost identificate 3,827 de cazuri relevante (persoane fizice), din datele post-autorizare. Țara cu cea mai mare incidență a fost Japonia, urmată de SUA și Marea Britanie.
Cel mai mare număr de cazuri raportate au fost în rândul femeilor, un șocant de 3,182 de cazuri față de 454 de cazuri la bărbați, cu o vârstă medie de 44 de ani. Faptul că au fost raportate de 7 ori mai multe cazuri la femei nu este o noutate. În decembrie 2021, I analizate a pregătit Pfizerul document pentru FDA, care acoperă perioada de 3 luni, din decembrie 2020 până în 28 februarie 2021 – în cazul anafilaxiei – femeile au fost de 8 ori mai afectate.
Deci, 98% dintre evenimentele adverse relevante (inclusiv reacția anafilactică, șoc anafilactic, reacția anafilactoidă și șoc anafilactoid) au fost clasificate ca fiind grave!
Mai mult, pentru 92% dintre evenimente, timpul scurs pentru ca un eveniment advers să apară după administrarea vaccinului a fost mai mic de 24 de ore.

Rezultate fatale
Dintre cele 3,922 de evenimente, 28 au fost fatale, iar pentru 704, rezultatul a fost necunoscut. Nu au fost date numere de cazuri pentru rezultate fatale.

Cazuri pe grupe de vârstă
Din cele 3,827 de cazuri relevante (indivizi), 23 au fost din grupa de vârstă pediatrică și 3,021 din grupa de vârstă adultă.
Prezența comorbidităților
Ceea ce este de remarcat este că aproximativ 2/3 din toate cazurile de anafilaxie au făcut-o nu au orice comorbidități (probleme de sănătate subiacente).

Având în vedere ceea ce s-a întâmplat de când au fost lansate vaccinurile ARNm COVID-19, nu este o surpriză să citiți: „nu au fost identificate noi informații de siguranță referitoare la riscul de anafilaxie cu BNT162b2” (vaccin Pfizer-BioNTech COVID-19). Motivul invocat (sau scuza în care se ascund) este că „acest risc este comunicat... care include informații cu privire la măsurile adecvate care trebuie luate, după cum urmează: „Ca și în cazul tuturor vaccinurilor injectabile, tratamentul medical adecvat și supravegherea trebuie să fie întotdeauna disponibile. în cazul unui eveniment anafilactic rar în urma administrării vaccinului.”
În Regulamentul 174, Informații pentru profesioniștii din domeniul sănătății din Marea Britanie, care a fost revizuit ultima dată în decembrie 2021, se precizează următoarele:

n fapt, de fapt prima zi din lansarea vaccinului Pfizer-BioNTech COVID-19 în Marea Britanie, au existat două rapoarte de anafilaxie și un caz raportat de o posibilă reacție alergică. Acest lucru nu a împiedicat MHRA să recheme produsul - pur și simplu au ocolit problema declarând că persoanele care au antecedente de alergii nu ar trebui să ia vaccinul.
Chiar și atunci când știau... Ingredientele din nanoparticule lipidice de la Pfizer/BioNTech ALC-0159 și ALC-0315 nu au fost niciodată incluse în niciun medicament autorizat înainte. ALC-0159 conține PEG (polietilen glicol) care este cunoscut că provoacă anafilaxie.
Este fără echivoc: anafilaxia a fost un eveniment advers cunoscut care pune viața în pericol, cam în aceeași perioadă în care a fost acordată autorizația de utilizare de urgență pentru vaccinul Pfizer-BioNTech COVID-19. Cu toate acestea, pentru că este un „vaccin injectabil”, a primit cumva o trecere gratuită de la toți autoritățile de reglementare a medicamentelor, indiferent de câte date blestemate se acumulează, atunci când un sirop de tuse sau o capsulă, pe de altă parte, este rechemat de urgență pe baza unui „a risc foarte rar de anafilaxie.”
Republicat de la autor Substive
Publicat sub a Licență internațională Creative Commons Attribution 4.0
Pentru retipăriri, vă rugăm să setați linkul canonic înapoi la original Institutul Brownstone Articol și autor.









